커뮤니티
부경투데이
- 국립 부경대학교의 다양한 모습과 소식을 접하시면 부경대학교가 한번 더 가까워집니다.
| 암 치료 신기술 개발 '주목'(‘Attention’ on the Development of New Technology for Cancer Treatment) | |||
| 작성자 | 대외협력과 | 작성일 | 2024-10-07 |
| 조회수 | 344 | ||
| 암 치료 신기술 개발 '주목'(‘Attention’ on the Development of New Technology for Cancer Treatment) | |||||
 |
대외협력과 |  |
2024-10-07 |  |
344 |
국립부경대·한국공학대·성균관대, ‘나노기포’ 이용 암 치료 신기술 개발
- 초음파에 반응하는 나노기포 … 암세포 핵까지 파괴해 전이암 치료
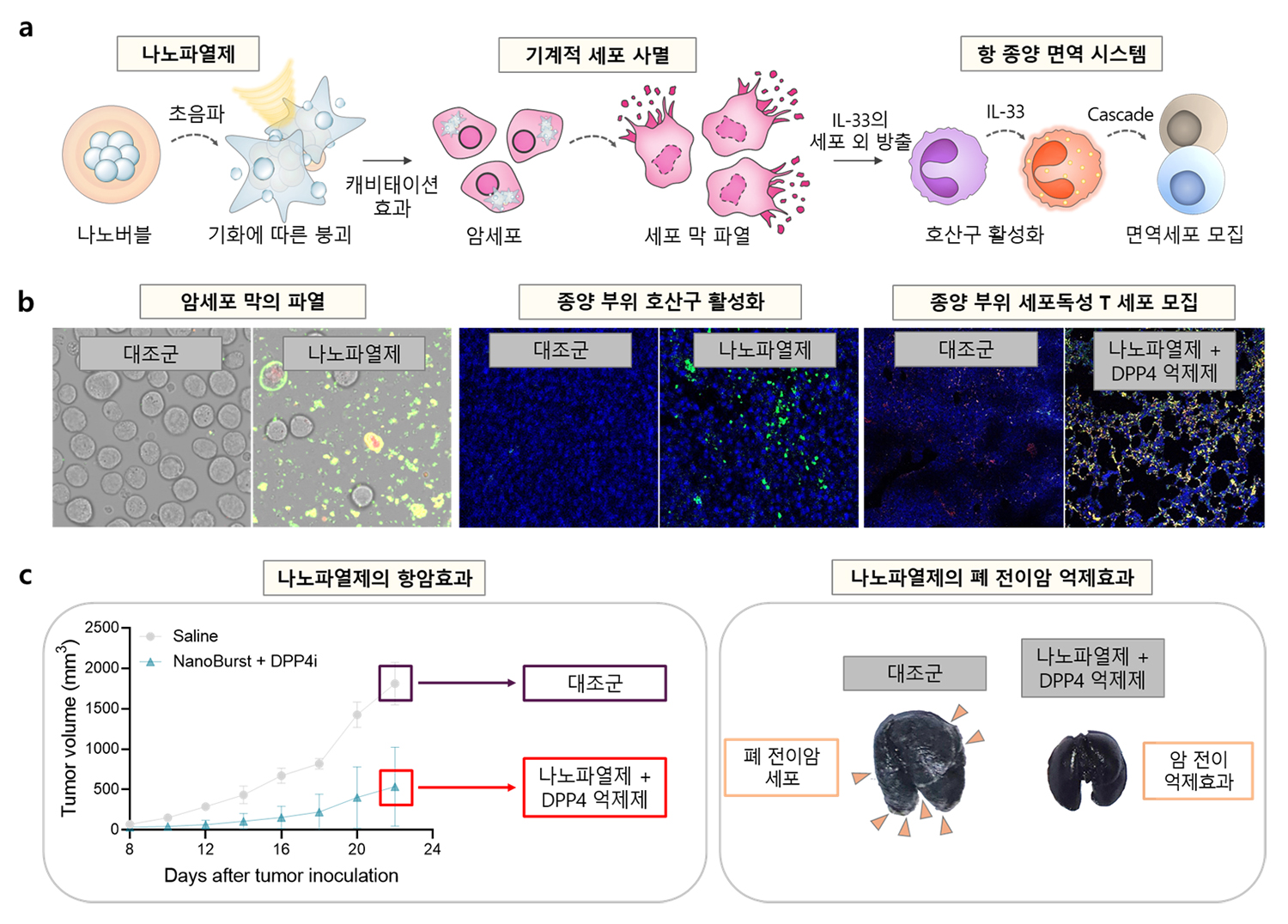
△ 나노기포를 이용한 새로운 기계적 사멸법과 이를 기반으로 한 암 치료법의 모식도.
국립부경대학교 생물공학과 엄우람 교수와 한국공학대학교 유동길 교수, 성균관대학교 박재형 교수 연구팀이 암 면역치료의 효능을 획기적으로 높일 수 있는 새로운 종류의 기계적 세포사멸법(caviptosis)을 세계 최초로 개발하는 데 성공했다.
암 면역치료는 인체의 면역기능을 활용해 암을 치료하는 방법으로, 기존의 항암 치료 대비 낮은 부작용과 뛰어난 치료 효과로 주목을 받고 있다. 특히 암세포에 의해 교란된 면역 작용을 정상화할 수 있는 대표적인 면역치료 방법인 면역관문억제제가 임상적으로 다양한 종의 암 치료에 최근 활발히 적용되고 있다.
하지만 최근 여러 연구에 따르면 종양미세환경에 존재하는 세포 독성 T 세포의 수가 부족한 경우 면역관문억제제 치료 효과가 크게 줄어드는 것으로 밝혀졌다. 이에 따라 암 면역치료의 효과를 높이고 치료 혜택을 더 많은 환자 집단으로 확장하기 위해 종양 부위로 외부의 면역세포를 불러들일 수 있는 신기술이 지속해서 요구돼 왔다.
엄우람 교수 연구팀은 백혈구의 일종인 호산구(eosinophils)의 역할에 주목했다. 일반적으로 호산구는 암 치료에 부정적인 영향을 끼친다고 알려져 있지만, 호산구가 세포핵 내부에 존재하는 인터루킨-33(IL-33)에 의해 자극받으면 종양 내로 면역세포를 불러들여 강력한 암 치료 효과를 나타낼 수 있다. 하지만 IL-33은 세포핵 내부에 단단히 결합돼 있어 호산구와 IL-33을 활용한 치료 방안은 극히 제한적이었다.
엄우람 교수 연구팀은 세포 내부로 침투할 수 있는 나노 크기의 기포를 활용해 초음파에 노출될 때 세포를 파열시킬 수 있는 기계적 세포사멸법(cavitopsis)를 개발하는 데 성공했다.
초음파에 반응하는 나노 기포로 만든 나노파열제가 암세포 내부의 핵까지 파열시키며 자연 상태에서는 거의 방출되지 않는 핵 속 IL-33을 세포 외부로 방출하고, IL-33이 호산구를 자극해 종양 내로 면역세포를 불러들이는 항암 효과를 규명해 낸 것이다. 연구팀이 실제 폐 전이암 쥐 모델에서 나노파열제의 치료 효능을 검증한 결과, 기존 면역관문억제제의 항암치료 효능이 비약적으로 향상되는 것을 확인할 수 있었다.
연구책임자인 엄우람 교수는 “현재 암 면역치료는 수천만 원 대의 고가에다 일부 환자에게만 효과를 보이는 한계가 있지만, 이번 연구를 통해 암 면역치료의 치료 효과를 극적으로 높여 기존 치료가 어려웠던 전이성 암의 치료 가능성을 높여줄 것으로 기대한다.”라고 밝혔다.
연구팀은 한국연구재단의 개인기초연구 및 국가신약개발사업의 지원을 받아 이번 연구를 수행하고, 연구결과는 국제학술지 <Advanced Functional Materials>에 송예리 연구원(성균관대), 유동길 교수가 제1 저자로, 엄우람, 박재형 교수가 교신저자로 게재했다.
한편 엄우람 교수 연구팀은 세포 기능 조절할 수 있는 나노기술을 활용한 암, 비만 치료 방법을 개발하기 위한 후속 연구를 진행하고 있다. <부경투데이>
Pukyong National University·Tech University of Korea·Sungkyunkwan University, Develop New Cancer Treatment Technology Using ‘Nano-Bubbles’
-Nano-Bubbles Responsive to Ultrasound… Destroying Cancer Cell Nuclei to Treat Metastatic Cancer
Professor Eom Woo-ram from the Department of Bioengineering at Pukyong National University, Professor Yoo Dong-gil from Tech University of Korea, and Professor Park Jae-hyung from Sungkyunkwan University have successfully developed a new type of mechanical cell death method(caviptosis) that can dramatically enhance the efficacy of cancer immunotherapy, marking the first development of its kind in the world.
Cancer immunotherapy is a method of treating cancer by utilizing the body's immune function, and it is gaining attention for its lower side effects and superior treatment effects compared to traditional chemotherapy. In particular, immune checkpoint inhibitors, which are a representative method of immunotherapy capable of normalizing immune responses disrupted by cancer cells, are being actively applied clinically to treat various types of cancer.
However, recent studies have shown that when there is a deficiency in the number of cytotoxic T cells present in the tumor microenvironment, the effectiveness of immune checkpoint inhibitor therapy significantly decreases. Consequently, there has been a continuous demand for new technologies that can attract external immune cells to the tumor site to enhance the efficacy of cancer immunotherapy and expand treatment benefits to a larger patient population.
Professor Eom Woo-ram's research team focused on the role of eosinophils, a type of white blood cell. Although eosinophils are generally known to have a negative impact on cancer treatment, they can be stimulated by interleukin-33 (IL-33), which resides inside the cell nucleus, to attract immune cells into the tumor and exhibit strong anti-cancer effects. However, IL-33 is tightly bound within the cell nucleus, making treatment options utilizing eosinophils and IL-33 extremely limited.
Professor Eom Woo-ram's research team successfully developed a mechanical cell death method (cavitopsis) that can rupture cells when exposed to ultrasound by utilizing nano-sized bubbles capable of penetrating into the cells.
The nano-explosive agent made from nano-bubbles responsive to ultrasound ruptures the nuclei of cancer cells, releasing IL-33, which is hardly released in its natural state, into the extracellular space. This IL-33 stimulates eosinophils to attract immune cells into the tumor, elucidating its anti-cancer effect. The research team validated the therapeutic efficacy of the nano-explosive agent in a real lung metastatic cancer mouse model, confirming a dramatic enhancement in the anti-cancer efficacy of existing immune checkpoint inhibitors.
The principal investigator, Professor Eom Woo-ram, stated, “Currently, cancer immunotherapy is very expensive, costing millions of won, and has limitations as it is effective only for a subset of patients. However, I expect that this research will dramatically enhance the therapeutic efficacy of cancer immunotherapy, increasing the potential for treating metastatic cancers that have been difficult to treat with existing therapies.”
The research team conducted this study with the support of the National Research Foundation of Korea’s Individual Basic Research and National New Drug Development projects. The research results were published in the international journal <Advanced Functional Materials>, with researcher Song Ye-ri (Sungkyunkwan University) and Professor Eom Woo-ram as first authors and Professors Eom Woo-ram and Park Jae-hyung as corresponding authors.
Meanwhile, Professor Eom Woo-ram's research team is conducting follow-up research to develop cancer and obesity treatment methods utilizing nanotechnology that can regulate cellular functions. <Pukyong Today>